人体内细胞是一个精密运转的工厂,细胞核是拥有中央控制系统的核心车间。这个“总控室”内存在多个无膜分隔的工作站——细胞核亚结构,它们就像工厂里无需物理隔断却能各司其职的作业小组。
5月27日,国际学术期刊《细胞》发表了中国科学院分子细胞科学卓越创新中心陈玲玲研究团队的一项最新研究成果。该研究揭示了灵长类特有的一种无膜“应急工作站”——核应激小体的运作奥秘,为理解生命如何应对外界刺激、调节过度炎症反应打开新思路。
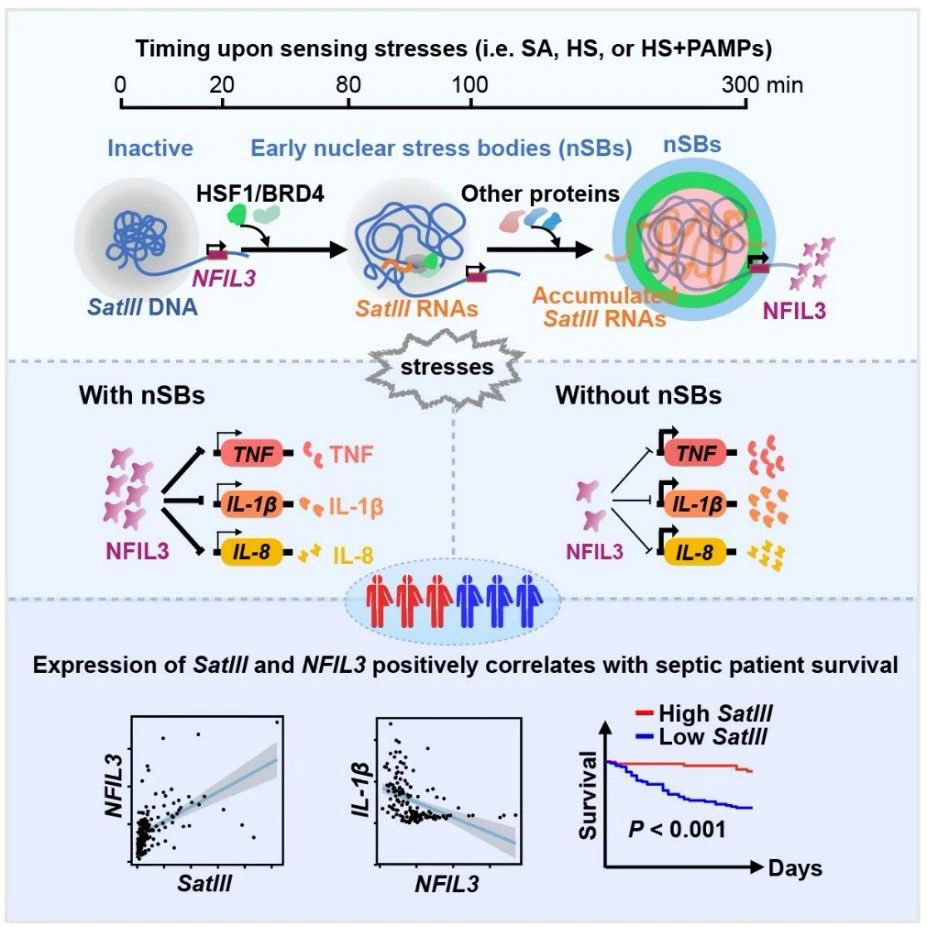
细胞核应激小体 (nSBs) 的从头组装参与调控急性炎症反应。 中国科学院分子细胞科学卓越创新中心供图
当细胞遭遇高热等“生存危机”,细胞核内会迅速组建应急工作站:转录因子HSF1蛋白质快速定位到特定的DNA压缩区——异染色质,指挥生产出高度重复的SatIII RNA作为“脚手架”。这些RNA分子如同应急工作站的钢架结构,吸引包括HSF1和转录调控因子BRD4等众多蛋白质“工程师”前来组装,最终建成有序结构的核应激小体。
这个应急工作站建立后,使得一些重要基因如NFIL3拉近了与它的空间距离,HSF1和BRD4两位蛋白质“工程师”协同工作,使NFIL3等基因的转录增强,从而产生更多NFIL3蛋白质。NFIL3蛋白质是转录抑制因子,相当于炎症反应的“刹车片”,能有效抑制炎症因子例如TNF、IL-1β、IL-8的过度产生。
研究团队在对人体免疫细胞中的巨噬细胞进行体外实验时发现,当遭遇高热与细菌感染刺激时,成功组建核应激小体的巨噬细胞能显著提升NFIL3蛋白质产量,使炎症因子可控表达;而人为破坏这个应急指挥部,则会导致炎症因子表达失控,产生过度保护性反应。
这项突破阐明了生命体利用产生核应激小体应对危机的精妙策略,也为脓毒血症诊疗提供了全新视角。
脓毒血症是感染引发的全身性炎症反应,病死率高。研究团队在收集的临床样本中发现,脓毒血症患者体内有核应激小体产生,并且NFIL3基因与SatIII表达量和核应激小体活跃度呈正相关。此外,SatIII表达高的患者生存率更高,提示SatIII RNA可以作为脓毒血症精准治疗分型标志物,也为此类炎症疾病治疗带来潜在靶点。
转载请注明来自夏犹清建筑装饰工程有限公司,本文标题:《上海科学家最新揭秘:细胞核内的“应急工作站”如何调控急性炎症》









 京ICP备2025104030号-16
京ICP备2025104030号-16
还没有评论,来说两句吧...